上海金畔生物科技有限公司代理New England Biolabs(NEB)酶试剂全线产品,欢迎访问官网了解更多产品信息和订购。
产品资料 – 糖生物学与蛋白质工具 – 噬菌体展示
Ph.D.-7 噬菌体展示肽库试剂盒 v2 收藏
货 号
规 格
价 格(元)
北京库存
上海库存
广州库存
成都库存
苏州库存
#E8211S
10 panning experiments
7,859.00
无
无
无
无
无
Download:
- isoschizomers |
- compatible ends |
- single letter code
说明
本产品可直接替代 NEB # E8100S,Ph.D.™-7 噬菌体展示肽库试剂盒
特性
Ph.D.-7™ 噬菌体展示肽库试剂盒 v2 包含 Ph.D.-7 噬菌体展示肽库、淘选实验中用作对照的DYKDDDDK 小鼠单克隆抗体、Protein G 磁珠,以及足够 >50 个测序反应的 -96 gIII 测序引物。Ph.D.-7 噬菌体展示肽库是一种随机 7 肽组合库,随机多肽与 M13 噬菌体的次要外壳蛋白(pIII)的 N 端融合表达。该肽库由约 109 种电转化(即独特的)的序列组成。
·即用型噬菌体肽库完整试剂盒(约 109 个克隆)
·新增用于对照淘选实验的单克隆抗体和 Protein G 磁珠
·相比之前的靶蛋白(链霉亲和素),对 DYKDDDDK 小鼠单克隆抗体能淘选出更可靠的表位结果
·不需要辅助噬菌体进行扩增
·利用表型和基因型之间的固有关联,在单个微量滴定孔或 EP 管中对数十亿个克隆进行筛选
概述
噬菌体展示是一种体外筛选技术。它可以将一系列多肽或蛋白质库展示在噬菌体颗粒的外部,而编码这些蛋白的 DNA 则位于病毒颗粒内部 (1-3)。利用展示蛋白与其编码 DNA 之间的关联,我们可以通过一种称为“生物淘选”的体外筛选方法 (4),快速筛选出与给定靶分子(抗体、酶、细胞表面受体等)亲和结合的噬菌体展示肽。最简单的淘选方法是(见图 1):将展示不同多肽的噬菌体库与固定在平板或小珠上的靶分子孵育,先洗去未结合的噬菌体,而后洗脱特异性结合的噬菌体,扩增洗脱下的噬菌体。重复上述结合/扩增过程,使与靶分子结合的多肽序列的噬菌体得到富集。经过 3-4轮筛选后,每个克隆通过 DNA 测序或 ELISA 鉴定克隆。
Ph.D.-7 噬菌体展示肽库试剂盒 v2 的主要原理是将随机七肽库融合表达于 M13 噬菌体次要外壳蛋白 (pIII) 的 N 端(5-9)。随机七肽和野生型 pIII 序列之间,是一个短间隔序列(Gly-Gly-Gly)。该肽库由约 109 种电转化的序列扩增一次后获得,在 10 μl 提供的噬菌体肽库中,每种序列大约100 个拷贝。
展示肽的连接形式:X7-GGG-野生型 M13 pIII
图 1:对展示于五价 pIII 蛋白上的多肽库进行淘选。
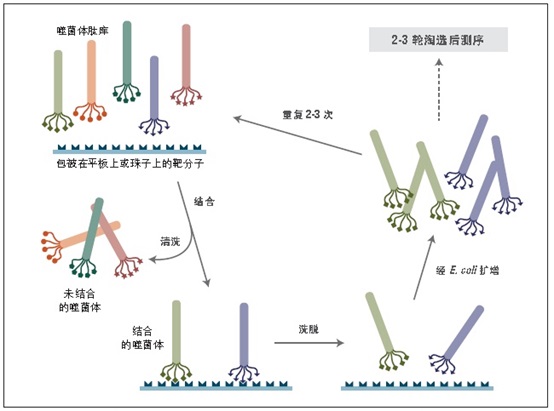
特点:
·对照淘选实验不需要封闭步骤,避免了噬菌体与塑料板发生非特异性结合;
·使用 Protein G 磁珠进行对照淘选实验,减少了繁琐的板/孔洗涤步骤;
·即用型噬菌体肽库完整试剂盒,提供了理论上所有可能出现的七肽序列(207 = 1.28 x 109);利用表型和基因型之间的固有关联,能在单个微量滴定孔或 EP 管中对数十亿个克隆进行筛选;
·不需要辅助噬菌体进行扩增;
·利用简单的分子生物学和无菌培养技术,在不到一周的时间内筛选到特异性结合的多肽;
·提供 -96 gIII 测序引物 (500 pmol),支持 >50 次测序反应。
注意事项
·对于 >30 天的长期储存,建议在 -80°C 条件下储存大肠杆菌 K12 ER2738。
·Protein G 磁珠应储存在 4°C,以防止因冷冻而损坏。
·原始版本 (NEB #E8100) 和新版本 (v2) 试剂盒 (NEB #E8211) 所提供的 Ph.D.-7 噬菌体展示肽库 (NEB #E8102) 完全一样。
·M13 与大多数缓冲液兼容; 然而,洗脱缓冲液可能会受到扩增所需的大肠杆菌培养条件的限制。如果使用二代测序,可以省略用于富集噬菌体库的扩增步骤。参阅最新文献以获取操作说明。
·提供的 -96 gIII 测序引物 (500 pmol) 支持 >50 次测序反应。
参考文献
1. Sidhu, S.S. (2000). Curr. Opin. Biotechnol.. 11, 610-616.
2. Rodi, D.J. and Makowski, L. (1999). Curr. Opin. Biotechnol. . 10, 87-93.
3. Wilson, D.R. and Finlay, B.B. (1998). Can. J. Microbiol.. 44, 313-229.
4. Parmley, S.F. and Smith, G.P. (1998). Gene. 73, 305-313.
5. Scott, J.K. and Smith, G.P. (1990). Science. 249, 386-390.
6. Whaley, S.R. et al. (2000). Nature. 405, 665-668.
7. Noren, K.A. and Noren, C.J. (2001). Methods. 23, 169-178.
8. Rozinov, M.N. and Nolan, G.P (1998). Chem. Biol.. 5, 713-728.
9. Rodi, D.J. et al. (1999). J. Mol. Biol.. 285, 197-203.
